saRNA 激活 让基因内核驱动表达成为可能
目前, 研究基因沉默或降低表达,(Knock Out,KO 和Knock Down, KD)是研究基因功能的常用技术方案,包括诸如化学合成 siRNA、载体构建 shRNA、针对基因组 KO 的 cas9、针对 RNA 的 CRISPRi 等。但如果需要对靶基因过表达, 可选择的方案较少, 通常采用构建外源基因过表达载体,CRISPR SAM和saRNA外三种方案, 其中外源导入基因过表达(overexpression,OE)是常用的技术方案, 大多研究人者只了解构建外源过表达或这采用CRISPR-SAM 两种方法,往往受限于基因片段太长而实际工作困难重重或效果不佳。
saRNA(small activating RNA),为基因过表达提供解决新策略 。
saRNA 是由 21 个核苷酸组成的小分子非编码双链 RNA,其与siRNA作用机制完全相反,是通过靶向基因上游及启动子区域,引发染色质构象的改变或者改变组蛋白及 DNA 甲基化修饰水平,从而引发转录激活作用, saRNA 可通过作用于抑癌基因启动子的特定序列来上调或激活靶基因的表达,实现抑制癌细胞的增殖、侵袭和迁移行为,研究 saRNA和 RNAa 的作用机制,为肿瘤的预防或治疗提供切实可行的方法。做为一种新的研究工具,saRNA作用机制具有复杂性,随着越来越多的 saRNA 研究数据被验证有效,其作用机制也在逐步阐明,saRNA针对基因的可设计性、特异性、长效性及普适性,使得我们通过激活抑癌基因的表达来治疗肿瘤显得更具可操作性。 saRNA目前将为肿瘤、遗传性代谢疾病的治疗等方面提供了一个全新的思路和广阔的临床应用前景。
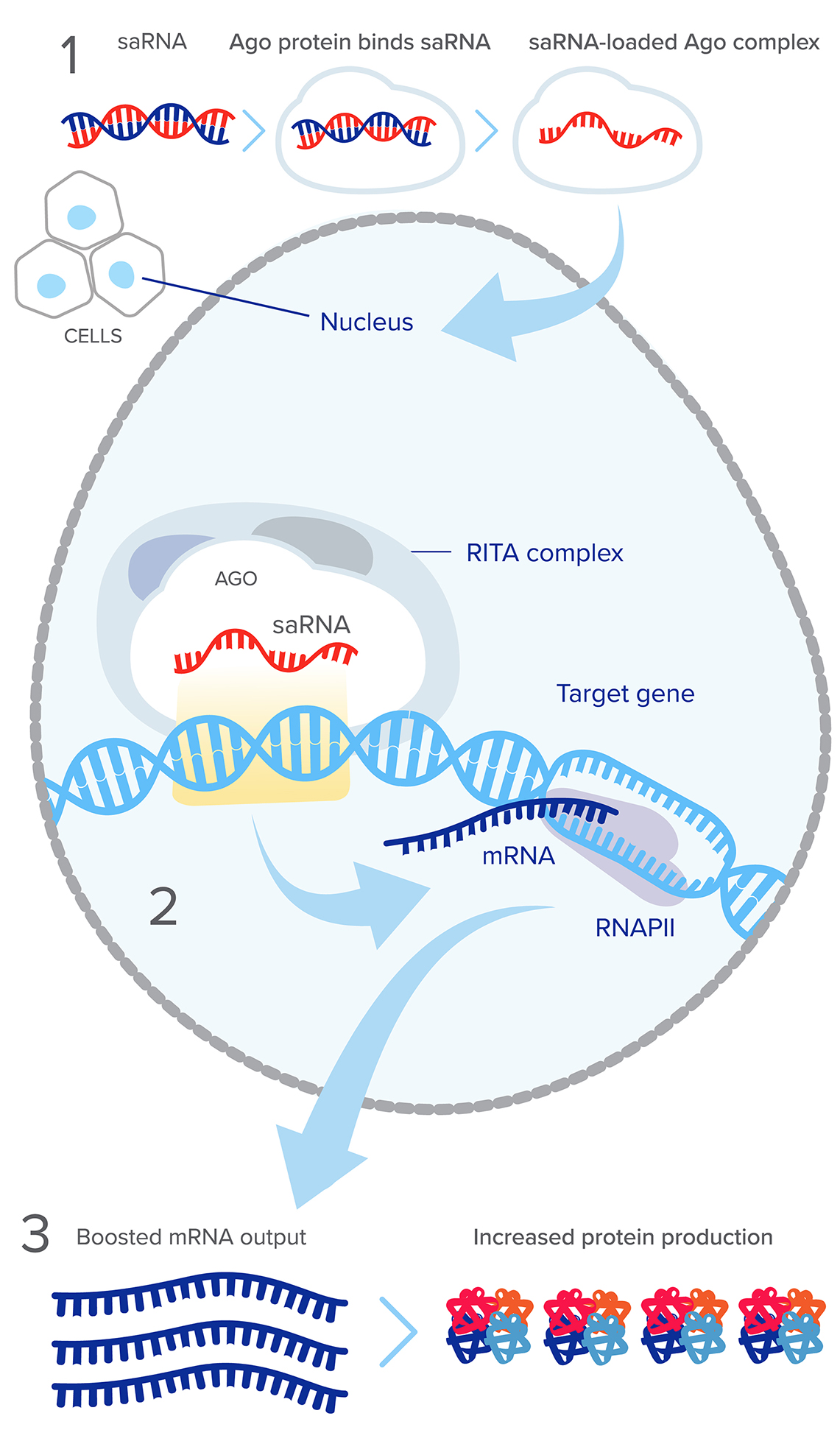
【saRNA 的分子机制,图示源自ractigen.com】
saRNA 机制在机体中是广泛存在的,细胞主要依靠 miRNA、piRNA 实现激活途径,如 mir-373 靶向 E-cadherin 和 CSDC2 启动子的激活2、果蝇中 piRNA 触发的转录活性3。
国内科研工作者早前以 p21-saRNA 向肿瘤细胞递送 p21-saRNA 评估抗肿瘤能力4(p21 基因下调是结直肠癌的标志之一),为后续治疗结直肠癌提供选项,效果如何呢?
研究人员以 p21-saRNA-322(322 对应启动子区域的相对位置,图 2)递送三种大肠癌细胞(HCT-116,HCT-116(p53 – / –)和 HT-29),通过 QPCR 以及 WB 检测了 p21 基因的表达(图 3),结果显示,saRNA-322 于 72 h 显著提升了 p21 的表达水平。
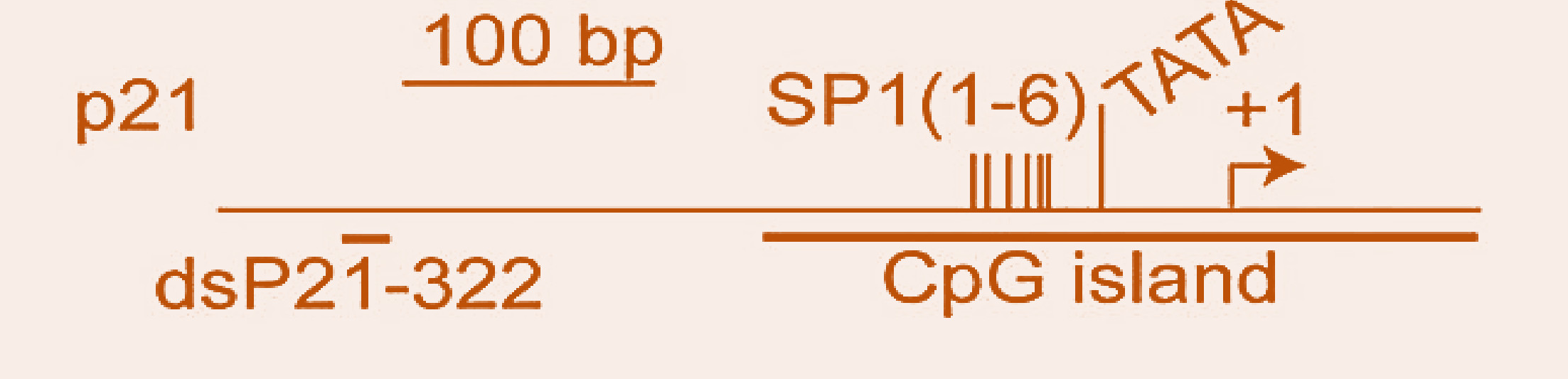
【p21-saRNA-322 靶点设计示意图】
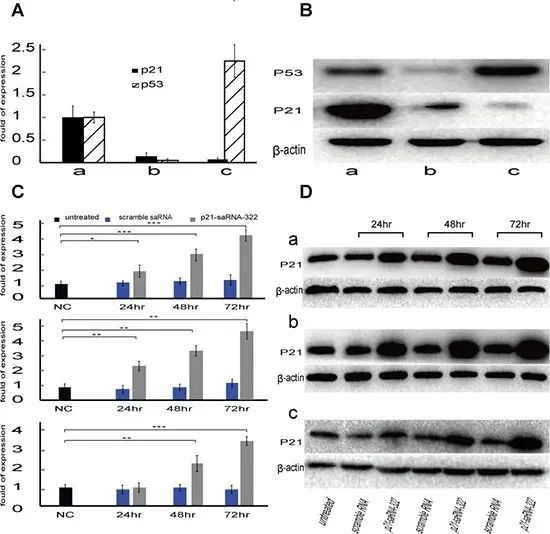
【p21-saRNA-322 上调大肠癌细胞 p21 基因的 QCPR,WB 实验】
研究人员以流式分析确认了 p21-saRNA-322 大肠癌细胞在 G 0 / G 1 期细胞发生周期停滞(数据见原文),并同时在动物水平,验证了 p21-saRNA-322 对于肿瘤发生的抑制性:

【裸鼠成瘤及瘤体检测】
【持续五周的裸鼠实验数据,每 3 天瘤内注射 a 组 PBS,b 组 Scramble RNA,c 组 p21-saRNA-322;(A)裸鼠成瘤;(B)肿瘤提取;(C)对肿瘤的重量、体积测量;(E)肿瘤切片 p21 染色)】
由此可见,p21-saRNA-322 在三种大肠癌细胞都实现了 p21 基因的上调,并在细胞与动物水平实现了表型的改变。需要指出的是,同个 saRNA 在不同细胞系,促进水平是有差异性的。在 PC-3,HeLa 和 MCF-7 细胞中,与 saCON 相比,p21-saRNA-322 对 RNA 诱导分别为 12.5 倍,10.1 倍和 2.4 倍。

【p21-saRNA-322 对三种细胞的表达提升水平】
p21-saRNA-322 在多种细胞实现靶基因的上调在 E-cadherin 基因上得到了重现5,显示出 saRNA 机制在细胞是普遍存在的,这为进一步的基因治疗开发提供了可能性。关键蛋白表达的下降通常是许多疾病的主要原因,尤其是单基因沉默表达所引发的临床疾病。恢复细胞中这些蛋白表达的新技术有待开发。虽然目前的技术手段有 mRNA、Crispr cas9-SAM、反义寡核苷酸和 saRNA。但是无法合成长片段的 mRNA、Crispr 受困于脱靶效应及递送方式,T7 体外转录的 RNA 可能产生异常的副产物,这些都限制了向基因治疗方向的运用。而 saRNA 由于其序列较短、生产成本低且可控等因素,有进一步开发为药物的优势,当然也需要克服免疫原性、脱靶性,以及合适的递送方式(纳米递送、脂质体、外泌体等)这些问题6。目前处于开发中的国外与国内saRNA 药物如下:

【开发中的saRNA药物管线,图示源自药企官网】
对于科研人员,结合研究目需求,选择saRNA 方案提供了除外源转入过表达OE、CRISPR-SAM 两种常用技术之外的第三种思路,尤其是针对大基因无法构建包装的情况下。如果将saRNA重组至载体上,虽然可以获得稳定激活的效果,但载体所产生的dsRNA可能会导致细胞处理dsRNA的能力达到饱和而影响细胞的正常功能。 目前,研究人员正在尝试对saRNA进行化学构架修饰,以解决以上问题。
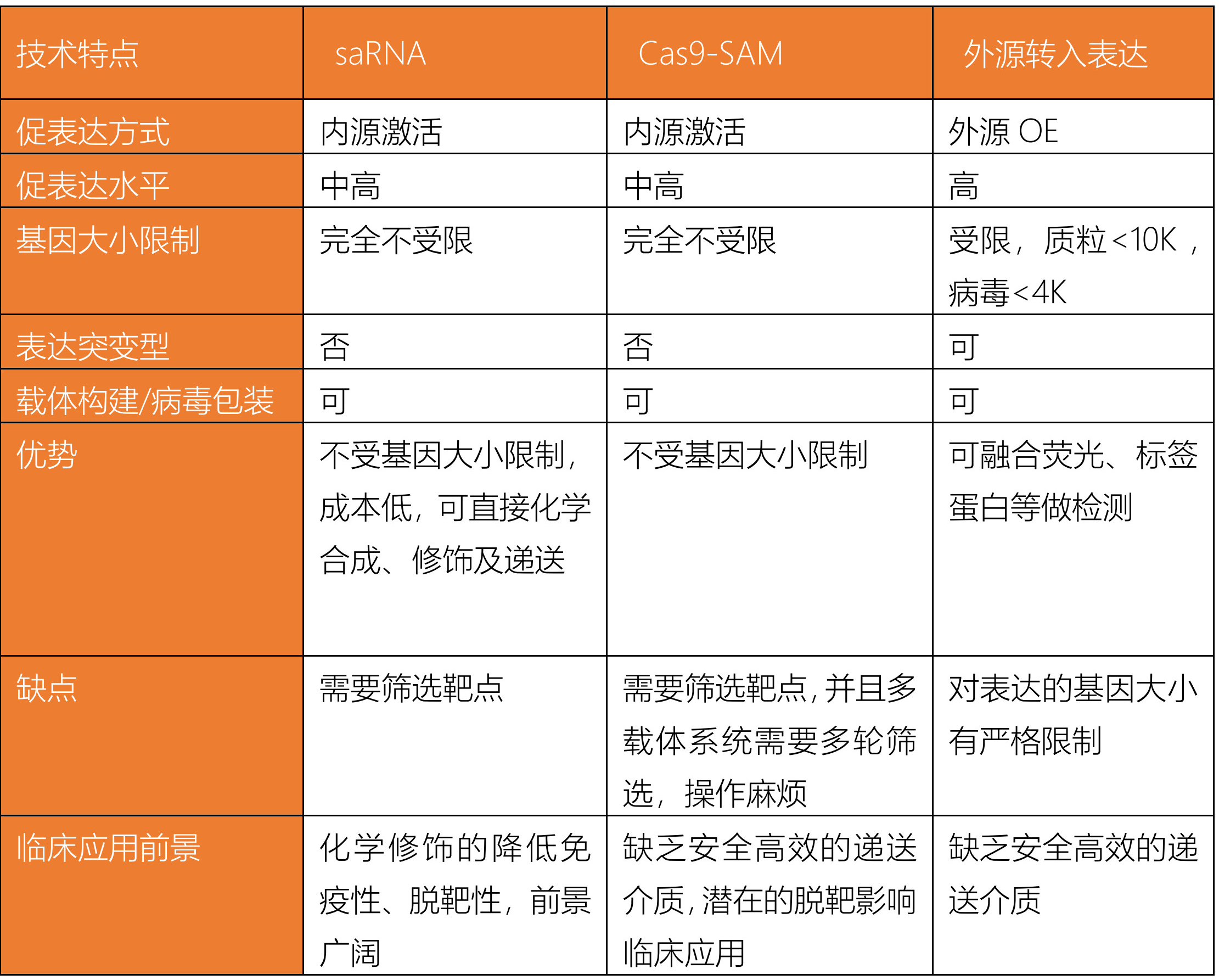
【三种基因过表达方案对比】
不同的基因过表达方式适合不同情形的实验,虽然各有优劣,但 saRNA 对于单基因下调引发的疾病治疗具有广阔的开发前景。RNAa技术将成为一种快速、简洁和高效的上调目的基因表达的手段,且克服了转染实验中重组蛋白特异性聚集和转染效率不高的缺点。与RNAi技术相比,RNAa具有更直接的分子结合、更强的表达反应和持续时间。与转基因技术相比,RNAa避免了将外源性基因导入体内,可直接激活沉默基因或者上调低活性基因的表达。并且,saRNA在激活目的基因的过程中,有良好的靶向性,可灵活选择靶点,对靶基因作用强效,因此RNAa在基因治疗方面有巨大的优势。
另外,与传统的基因过表达手段相比,saRNA还具有构建简单和耗费低等优点。已有研究人员将此技术运用于肿瘤抑癌基因的激活,结果显示saRNA对肿瘤细胞生长的抑制作用强效,至少持续1周以上。saRNA介导的基因激活在肿瘤发病机制研究和治疗方面具有优势,因此saRNA是基因治疗的又一理想工具。虽然目前RNAa的具体机制还有待进一步研究,但RNAa将有希望成为质粒过表达系统的替代工具。
密生基因通过生信合理化分析设计、化学修饰等方式,提高靶点设计成功率,可为客户提供 saRNA 的一站式靶点设计及saRNA Oligos 修饰合成Kit、siRNA修饰合成、病毒包装、细胞株构建、真核及原核蛋白表达与检测纯化等项目服务,如果对saRNA感兴趣,赶快带着基因来咨询吧!
【参考文献】
1. Developing small activating RNA as a therapeutic: current challenges and promises
2. MicroRNA-373 induces expression of genes with complementary promoter sequences
3. An epigenetic activation role of Piwi and a Piwi-associated piRNA in Drosophila melanogaster
4. Specific up-regulation of p21 by a small active RNA sequence suppresses human colorectal cancer growth
5. Small dsRNAs induce transcriptional activation in human cells
6. Targeted Delivery of C/EBPα -saRNA by Pancreatic Ductal Adenocarcinoma-specific RNA Aptamers Inhibits Tumor Growth In Vivo
7. Activating gene expression in mammalian cells with promoter-targeted duplex RNAs.
(上述研究数据图片源于科研文献,如有侵权,联系删除)