RNA时代成药加速,行业赛道梳理
前 言
在生物学的中心法则中,蛋白处于最下游,过去几十年,我们围绕蛋白功能开发小分子药物和抗体药物,并形成了相对成熟的开发路径。但蛋白靶点的复杂结构增加了获得最好的构效关系的难度,需要大量的化合物库筛选和化合物优化。随着成熟靶点越来越少,近10年新药开发的效率并没有提升太多,从I期临床到获批上市平均需要10.5年时间,平均成药率为7.9%。向中心法则上游走,通过新机制来开发药物是一个重要趋势,从蛋白往上推一层级的RNA相关疗法或许将成为继小分子和抗体后的第三大药物形式。RNA是一种核苷酸序列,因为碱基对的天然配对机制,为药物研发程序化设计(序列设计)、平台化开发(递送平台)带来可能。此外,RNA是DNA到蛋白的中间过渡产物,因此,一般认为以此作为靶标具有更好的安全性,不会出现编辑DNA所带来的长期的不可逆风险的担忧。
(中心法则与药物研发方向示意图,资料来源:点石整理)
本行研报告针对RNAi、SaRNA、tRNA、cicrRNA、靶向RNA小分子五种RNA进行分析和展望RNA相关疗法的现状和未来。
1. RNAi(RNA干扰)
RNAi疗法机制
人为设计特异性的siRNA(小核酸片段),达到细胞内部后形成RISC(RNA诱导沉默复合体),该复合体特异性得结合与siRNA互补的mRNA片段,引导复合体将目标mRNA分解,从而阻碍了mRNA的翻译,通过这种方法,消除体内致病蛋白。
(RNAi原理,资料来源:Olix Pharmaceuticals IR book)
对于过表达蛋白或异常表达蛋白引起的疾病,RNAi疗法具有非常好的前景。
RNAi疗法的开发历史:经历荣光与泡沫
1998年RNAi现象首次被科学发现。
2001年,被《Science》评为十大科学进展。
2003年,被《Fortune》誉为价值万亿美金的生技突破。
到2006年,Andrew Z.Fire和Craig C.Mello因发现RNAi被授予诺贝尔生理与医学奖。RNAi迎来高光时刻。
而工业界也嗅到了RNAi带来的巨大潜力纷纷重金布局,其中以默沙东和罗氏为代表,前者以11.5亿美金买下Sirna公司,后者则与Alnylam达成10亿美金合作。
虽然RNAi在机制方面看起来前景无限,但在当时很快受到了递送技术的限制而进入低谷,这个时间不过2-4年,工业界甚至发出了“Is RNAi Dead”这样的疑问。似乎任何新生技术都逃不出“前景是光明的,但道路是曲折的”发展路径。
罗氏和诺华几乎同一时间终止了RNAi的开发,而重金布局的默沙东则以15折的折价把Sirna公司卖给了Alnylam,不得不说Alnylam的坚定和胆识,敢于逆向布局。
(RNAi的早期药研发展历程)
纵观历史,只有Alnylam和Dicerna两家公司真正穿越了行业早期发展的跌宕起伏周期,成为行业黑暗时期的“火种”。
穿越周期,王者归来
Alnylam的坚守,终于在2018年迎来了全球第一款RNAi上市药物,当前Alnylam无疑是RNAi领域的绝对龙头,全球范围内共4款RNAi药物获批上市,Alnylam占了3款,剩下的1款则是诺华收购的The Medicines Company开发的产品,且仅在欧洲获批。
(Alnylam有3款RNAi药物上市,资料来源:Alnylam年报)
2020年Blackstone向Alnylam提供了20亿美金的综合投资,包括引进产品、股权、债券等,刷新了biotech领域最大的单笔私募投资的记录。
RNAi全球格局(不含中国):呈现三梯度
全球聚焦RNAi疗法的公司数量还比较少,Alnylam在市值上处于绝对领先,一些比较老牌的如Arrowhead和Dicerna则处于腰部,这个阶段的企业往往会成为big pharma并购的标的,小型的企业则还处于市值底部,如Silence Therapeutics刚IPO不久。
国外RNAi公司,资料来源:点石资本
Big pharma也在积极布局,对他们来说不差钱,但技术储备较弱,先通过跟RNAi领域的biotech合作来布局或许是个比较好的捷径,在合适的时候出手完成并购整合,比如,去年诺和诺德就以33亿美金并购Dicerna,此前两家公司也有多条合作管线。

(Dicerna和Arrowhead与big pharm的合作情况)
RNAi国内格局:整体处于比较早期发展阶段
国内RNAi疗法领域在此前很长一段时间,都主要是小型创业公司为主,其中以圣诺制药和瑞博生物走得最快,前者在去年12月底登陆港交所,成为国内小核酸第一股,最高市值近100亿港元;后者在去年5月冲刺科创板未通过。除了圣诺制药和瑞博生物外,国内其他RNAi赛道的公司管线基本都还处于临床前。
从去年下半年开始,国内RNAi赛道开始出现传统大药厂的身影,翰森制药和齐鲁制药先后以大金额里程碑付款与国外企业进行合作开发,其中翰森制药的两个交易入选

国内传统大药厂在RNAi领域的BD概况
国内传统大药厂以其强大的资金实力和商业化能力为赛道注入新的活力,但同时也给小型企业带来更多竞争挑战。
RNAi疗法展望:
RNAi疗法已经属于被初步验证的赛道,我们认为赛道将迎来高速发展期,我们预计会呈现几大特点:
- Fastfollow:涌现一批小型创业公司
- Innovation:新型递送系统,新型modality等.
-
RNAi在modality方面的创新
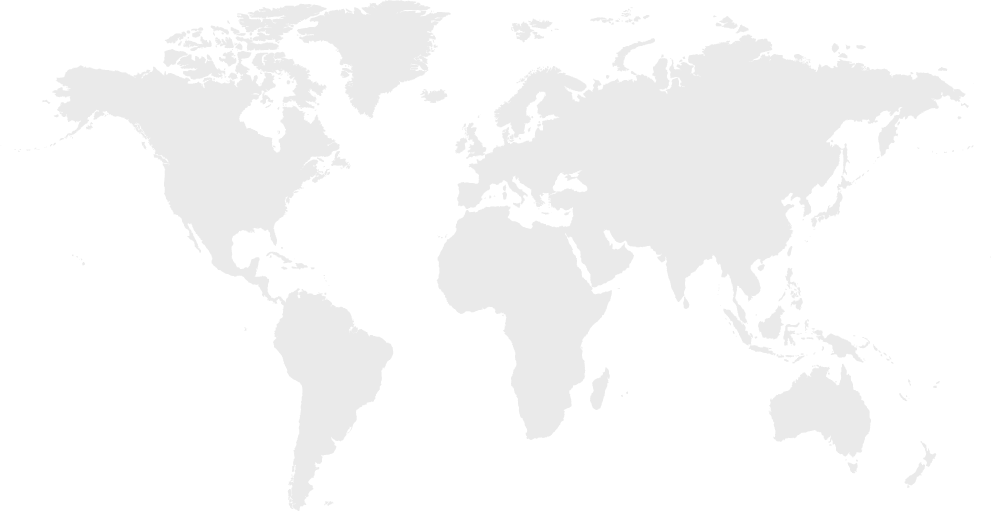
- Indication expand:逐步从目前肝病为主扩展到其他器官疾病.
(RNAi未来在适应症上的扩展可能,资料来源:Dicerna presentation)
- 合作与并购:合作开发仍是授权方获取资金、扩大技术影响力与市场占有率的重要方法,因此我们认为RNAi领域的BD会变得更为活跃。Big Pharma也在逐步回归这个领域,如诺华,虽然在行业早期未能占得先机,近期有传闻说意欲收购Alnylam,无论真假,并购似乎已经成为业内一种趋势共识。
-
2. saRNA(小激活RNA)
saRNA疗法机制:介导mRNA表达增加
当saRNA装载到Argonaute2(Ago2)蛋白后,其中的一条链被Ago2从中间切断并脱落;Ago2复合体进入细胞核,其与RNA解旋酶A相互作用形成Ago2-RHA复合体;复合体在染色体上寻找与引导链互补的基因序列并结合,吸引聚合酶相关因子1(PAF1)形成RNA介导的转录激活复合体,进一步吸引并激活RNA聚合酶II,导致mRNA表达的增加。目前主要用于研究肿瘤治疗。
RNA激活的优势
RNA激活主要利用短的非编码寡核苷酸来靶向和上调内源基因的转录,从而恢复蛋白质的天然功能。
具备几大优势:
(1)具有几乎无限的靶基因,持久激活靶基因;
(2)不改变基因组,恢复基因的天然功能;
(3)可利用已经成熟的siRNA药物化学及给药技术加速saRNA药的开发;
(4)进一步优化先导saRNA,可以提高其成药性及转录激活效率;
saRNA开发历程
RNAa最早在2006年于UCSF实验室发现,2008年,实验室授权给Alnylam进行药物研发。2012年,已在前列腺癌和膀胱癌进行临床前的研究。2014年,由于经济紧张,Alnylam在RNAi和RNAa两条路线上选择了RNAi,因此UCSF收回授权后重新授予MiNA公司。2016年RNAa治疗肝癌首次进入临床验证,2021年MiNA公司与礼来签署了12.5亿美元的协议,开发创新疗法。

saRNA与siRNA区别
saRNA与siRNA作用位置不同,saRNA主要在细胞核中发生作用,因此导致其相较于siRNA靶点暴露更难,递送也更为困难。
saRNA相关临床前及临床研究
- saRNA的临床相关研究主要聚焦在肿瘤领域,以P21基因研究居多
- Alnylam与实验室共同完成两项saRNA治疗肿瘤(前列腺癌/膀胱癌)临床前研究,均采用LNP递送saRNA,后资金困难,彻底放弃saRNA药物研发.MiNA的I期临床试验MTL-CEBPA联合PD-1进行实体肿瘤治疗的临床结果表明在部分患者中出现较好疗效。
-
saRNA相关公司
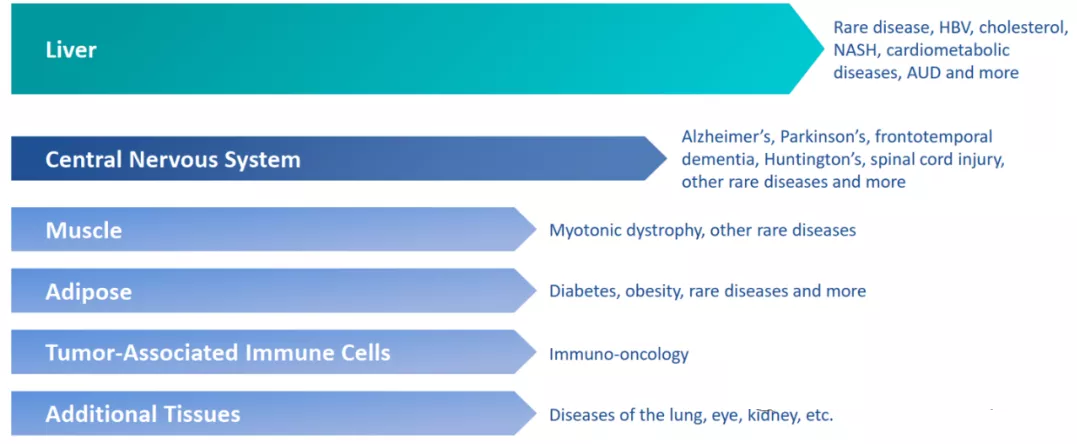
目前国内外有两家saRNA相关公司,国外主要是MiNA公司,其主要有6个研发管线,涉及多个靶点、包含实体瘤、罕见病、神经系统疾病等多个疾病。
MiNA公司管线,资料来源:MiNA公司官网)
目前国内中美瑞康saRNA 药物研发管线,涉及多个靶点、包含实体瘤、消化系统、罕见病、神经系统疾病等
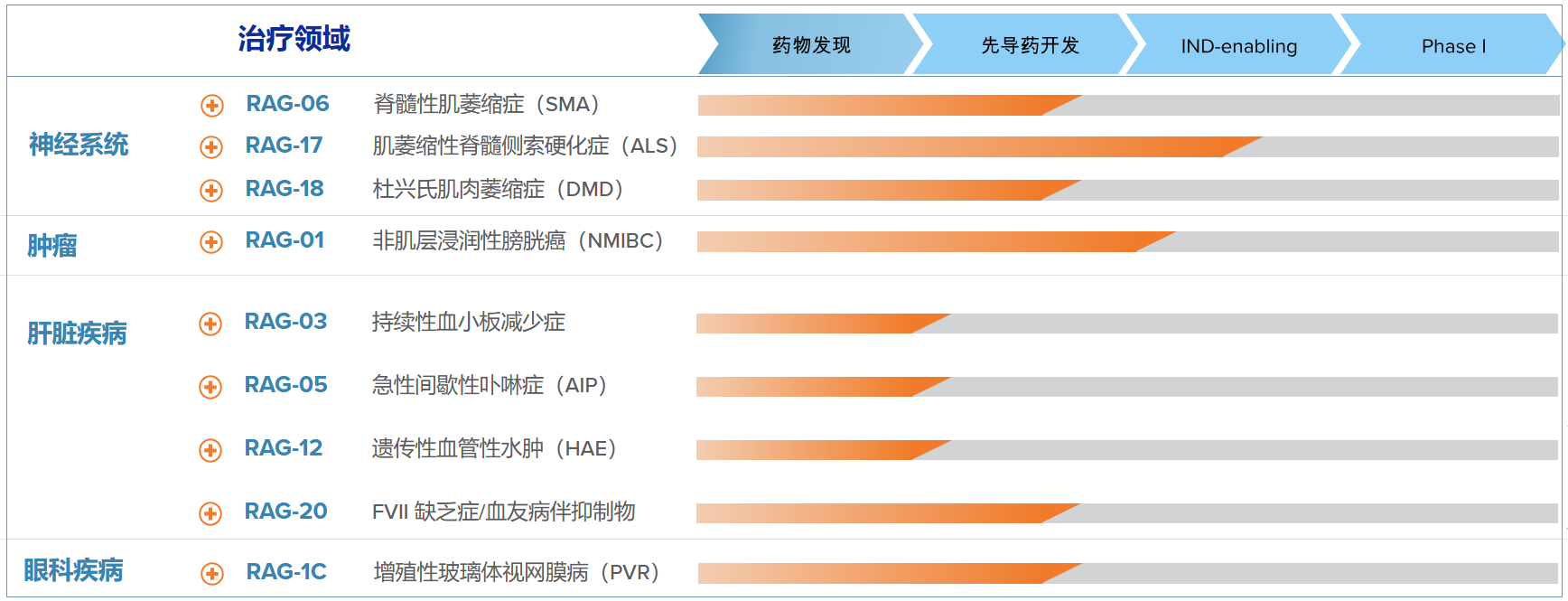
(Ractigen公司管线,资料来源:Ractigen官网)
3. tRNA(转运RNA)
tRNA疗法机制
目前研究的tRNA的疗法主要采用工程性抑制性tRNA治疗提前终止密码子的罕见疾病(PTC),该类疾病主要是由于基因的无意义突变导致蛋白容易出现降解,从而表达不全,导致疾病发生。针对无意义突变主要有两种治疗方式。一是引入人工合成的氨基酸。在外源性的氨酰tRNA合成酶作用下,结合在体内的抑制性tRNA结合形成氨酰tRNA。加入了非天然氨基酸,形成正常长度的蛋白质;二是采用工程性无意义抑制性tRNA。与内源性氨酰tRNA合成酶结合,结合对应氨基酸,形成氨酰tRNA,在PTC的位置上,形成正常蛋白质。
tRNA治疗的主要适应症
目前基于tRNA疗法主要应用于罕见疾病领域中。罕见病中有超过90%为单基因病,PTC疾病占单基因病的比例约为11%,根据我国近2000万的罕见病人群估算,我国约有超200万的PTC疾病人群。国外的基于tRNA疗法主要探究在杜氏肌营养不良、囊性纤维化、原发性纤毛运动障碍、Dravet综合征等。国内的研究还处在初步阶段。
tRNA药物开发的挑战
基于tRNA的治疗原理,未来可能存在一定挑战。考虑以下四个方面:(1)脱靶风险:工程化的tRNA体外细胞试验中目前未发现使得其他蛋白终止翻译(正常密码子),但体内试验中是否影响其他蛋白的翻译尚未可知;(2)药物递送:tRNA药物大概有70个左右碱基,高于RNAi、ASO等药物的20个碱基,脂质体递送存在一定毒性,AAV载量相对有限,因此对于药物递送存在一定要求;(3)体内稳定性:目前尚无相关数据表明体内能否利用正常的氨酰tRNA合成酶;(4)体内的免疫原性。
tRNA治疗的相关公司
目前海外公司致力于tRNA疗法的主要有四家公司,其中alltrna仅为tRNA疗法,其他的公司中均含有mRNA相关管线。四家公司在2021年都获得较大的资本投入。Recode的治疗囊性纤维化的tRNA药物有望在2022年达到IND阶段。

国外tRNA治疗公司
4. circRNA(环状RNA)
circRNA主要特征
circRNA由特殊可变剪切(back-splicing)产生,大量存在于细胞质中,主要来源于外显子,少部分内含子来源的circRNA存在细胞核中,其表达水平具有种属、组织、时间特异性。且由于circRNA呈闭合环状结构,不易被核酸外切酶降解,因此比线性RNA更加稳定。绝大多数circRNA是非编码的,但也有少数可以翻译为多肽。
circRNA的主要功能
目前circRNA可能有六大主要功能:
(1)环状RNA可以作为miRNA的海绵,保护靶mRNA免受依赖miRNA的降解
(2)含有RNA结合蛋白结合基序的环状RNA可作为这些蛋白的海绵,间接调控其功能
(3)环状RNA可以与特定蛋白质相互作用,并增强其功能
(4)一些环状RNA已被证明具有蛋白质支架的功能,促进酶(如磷酸酶、乙酰化酶和泛素连接酶)及其底物的共定位,从而影响反应动力学
(5)环状RNA也可能将特定的蛋白质募集到特定的位点
(6)具有内部核糖体进入位点(IRES)元素和AUG位点的环状RNA在一定条件下可以被翻译,产生独特的多肽
目前基于circRNA的疗法主要利用其与内部核糖体IRES结合的功能,翻译产生多肽,从而治疗疾病。
环状RNA的功能,资料来源:The biogenesis,biology and characterization of circular RNAs
circRNA的发展历程
环状RNA发现已经40余年,近年来随着通量测序技术及工程化技术的发展,环状RNA的潜力才得到大量开发。国外的两家主要的环状RNA公司均于2017-2018年成立。

2021年,上交大Bio-X研究院和美国密西根大学Cell Reports研究提出一个理论,环状RNA大部分源自剪接错误。他们主要研究了人类、恒河猴和小鼠的11个组织的RNA-seq数据,形成了四个观点:(1)基因反向剪接率随剪接程度增加而下降;(2)物种中反向剪接的丰度随其有效种群大小的增加而下降;(3)哺乳动物的环状RNA总体上在进化上是不保守的;(4)观测到的产生环状RNA的物质中有97%以上是有害的。根据其研究结果可以发现,大脑中的环状RNA可能是非剪接错误产生的。
环状RNA大部分源自自剪接错误
环状RNA公司的相关公司
国外主要有两家公司研究环状RNA疗法。Laronde与Orna therapeutics的药物研发原理大致相同,均采用IRES技术激活eRNA翻译,但主要研究及应用方向存在一定差异。Orna主要开发体内的CAR-T疗法。Laronde则是通过AI的方法搭建eRNA药物研发及治疗平台。
5. 靶向RNA的小分子药物
唯一上市的RNA调控小分子Evrysdi
2021年6月16日,中国国家药品监督管理局正式批准了罗氏重磅神经创新药物利司扑兰口服溶液用散(中文商品名:艾满欣®,英文商品名:Evrysdi®),用于治疗2月龄及以上患者的脊髓性肌萎缩症(SMA)。目前Evrysdi已经在全球包括美国、欧盟和中国在内的40多个国家和地区上市。与已上市的SMA疗法(基因疗法Zolgensma和ASO诺西那生)相比,小分子药物Evrysdi具有难以忽视的优势:
- 可透过血脑屏障,无需鞘内注射,给药方式简单、无痛苦,患者依从性强。价格合理,国内上市后每月治疗费用约为6.38万元。
- 适用人群广泛,包括所有类型SMA的婴幼儿、儿童、青少年、成人患者。安全性可控,不存在基因治疗所可能引起的严重肝损伤和急性肝衰竭风险以及未知的下游效应。
EVRYSDI、Spinraza和Zolgensma的对比
EVRYSDI自上市起销售额增长迅速,根据Evaluate Pharma&company documents预测,2026年EVRYSDI销售额将超过20亿美金,市场占有率超过诺西那生和Zolgensma。
Evrysdi的开发历程
但EVRYSDI在研发中经历的大量曲折,研发人员通过对20万以上的化合物库进行了层层筛选,历时20年的时间,最终EVRYSDI才得以上市,惠及SMA患者。
- 先导化合物发现阶段(14年):PTC通过对20万中小分子化合物进行表型高通量筛选,获得2000种有细胞表型的化合物,通过动物模型活性比较,对苗头化合物进行验证,最终确定了SMN-C1,C2,C3三种先导化合物,研究团队在2014年发表了首个口服SMN2剪切调控小分子研究。但是,由于化合物therapeutic index表现较差,RNA splicing调控效率低,分子毒性高,并未进行临床前研究。
- 化合物选择性优化验证阶段(2年):研究团队对先导化合物先后进行了结构优化(获得核心结构吡啶嘧啶-4-1)、构效关系研究(获得化合物RG7800)、非人灵长类毒理评价,最终优化得到PCC化合物Risdiplam。
- 临床试验阶段(4年):2016年,诺西那生获批上市;2019年,Zolgensma获批上市。EVRYSDI在临床试验阶段获得FDA的大力支持,美国FDA授予了Evrysdi治疗SMA的孤儿药资格(ODD)、上市申请快速通道资格(FTD)和优先审查(PR)。在Evrysdi获得批准时,FDA还颁发了基因泰克一张罕见儿科疾病优先审查凭证(PRV)。
-
靶向RNA小分子药物研发的挑战
通过对化合物库高通量筛选进行靶向RNA小分子药物研发的方法存在大量问题,但想要理性设计时,科学家们同样面临重重困难,其中包括:
- RNA三维结构数据匮乏,难以选择适合小分子靶向的RNA分子细胞中存在大量的调控性RNA和tRNA(>90%),mRNA难以靶向,且具有脱靶风险.
- RNA动态变化多样,需从中选出相对稳定的组分进行基于结构的分子设计小分子与RNA结合识别的原则和规律尚未明确.目前可供筛选的小分子库来源于与蛋白结合分子,不适用于RNA结合能力筛选.
- RNA独有的化学空间尚未明确.
- 因此如何通过理性设计,加速靶向RNA小分子药物研发流程,节省时间和资金,是现阶段靶向RNA小分子药物研发企业所面临的最重要的任务。目前全球RNA靶向小分子疗法研发公司已经初见规模,离不开深层AI计算和深厚的药物化学能力。此类公司绝大多数都希望通过AI辅助药物设计的方法,借助计算机虚拟筛选的方式,同时与团队内部具有丰富药物开发经验的药物化学家充分合作,共同快速发现生物化学活性优良的候选化合物分子。
但目前除EVRYSDI之外尚未有管线进入临床试验阶段,我们期待能有更多的理性设计的小分子靶向RNA药物被发现,这将意味着更多的疾病靶点能够被靶向,更多的患者可以享受性价比更高的治疗手段。
展望
RNAi近年几乎以每年获批一个的速度发展,已经是一个较为明朗的赛道,目前赛道进入适应症拓展以及新技术探索阶段。saRNA则有药物处于II期开发阶段,近年有可能取得突破性的进展。tRNA和cicrRNA则需要进一步完善技术并找到合适的应用。靶向RNA的小分子虽有EVRYSDI获批上市,但仍需更多的机理研究和理性设计来丰富应用方向。RNA相关疗法的曙光已现,如果回顾抗体药物的发展历程,我们相信RNA相关疗法也即将进入一个快速发展阶段。
抗体药物及RNA相关疗法上市数量
从全球药生物药研发视角, 新冠疫情是mRNA的发展助推剂,并延伸到其他RNA领域,从资本视角无疑为RNA行业带来了高估值溢价,希望业内企业在不同发展阶段均能有资本注入.推动RNAi药物的研发进程.
转,源自DAS Capital官网